江苏集萃药康生物科技股份有限公司品牌商
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
品牌商
江苏集萃药康生物科技股份有限公司
入驻年限:7 年
- 联系人:
药康生物
- 所在地区:
江苏 南京市 浦口区
- 业务范围:
抗体、细胞库 / 细胞培养、技术服务、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 科研机构
公司新闻/正文
中国科大研究发现天然淋巴细胞的骨髓外发育新路径,基因敲除小鼠功不可没
1063 人阅读发布时间:2022-03-18 16:44

肝脏内存有大量常驻的天然免疫细胞,如1型固有淋巴细胞 (ILC1s)、δγT和自然杀伤性T (NKT) 细胞。成年小鼠肝脏ILC1s主要分为CD49a-CD49b+常规自然杀伤 (cNK) 细胞和CD49a+CD49b- ILC1s两种类型。研究表明CD49a+CD49b-ILC1s几乎不参与外周循环,是一种肝脏驻留细胞[1]。而CD49a+CD49b-ILC1s在接受骨髓移植的小鼠肝脏中重建受损[2]。成年小鼠肝脏ILC1s的起源和发育仍待进一步探究和完善。
2021年3月,中国科学技术大学的田志刚院士团队在Science发表了题为“Liver type 1 innate lymphoid cells develop locally via an interferon-γ–dependent loop”的论文,证实成年个体肝脏中的ILC1s可通过IFN-γ依赖性环路由局部HSCs发育而来,揭示了髓外造血对肝脏特定区域免疫的贡献。该研究中使用的Ifngr1−/−(GRKO) 小鼠(T012667)以及Rag1−/−小鼠(T004753)是从集萃药康引进的。1.小鼠肝脏含有胎肝造血干细胞,可以产生肝脏中的ILC1s
作者通过流式分析发现成年期小鼠肝脏中含有Lin-Sca-1+Mac-1+的LSM细胞,同时肝脏中LSM细胞的比例明显高于骨髓、外周血和小肠固有层(Figure 1A, B)。研究人员将成年小鼠肝脏中纯化的LSM细胞通过肝门静脉注射转移到亚致死辐照的Rag1−/−小鼠中,发现LSM细胞在受体肝脏中优先分化为CD49a+CD49b−的ILC1s,而非cNK细胞 (Figure 1F)。上述结果表明,LSM细胞中含有ILC1s的前体细胞。进一步的流式数据表明小鼠肝脏中存在能分化为NK细胞的Lin−NK1.1−CD49b−CD122+细胞,并且该类细胞表达CD49a。将CD45.1+小鼠肝脏中CD49a+/CD49a-Lin−CD122+细胞分别回输到辐照后的CD45.2+Rag1−/−小鼠体内,发现CD49a+细胞会优先分化为ILC1s (Figure 1I)。
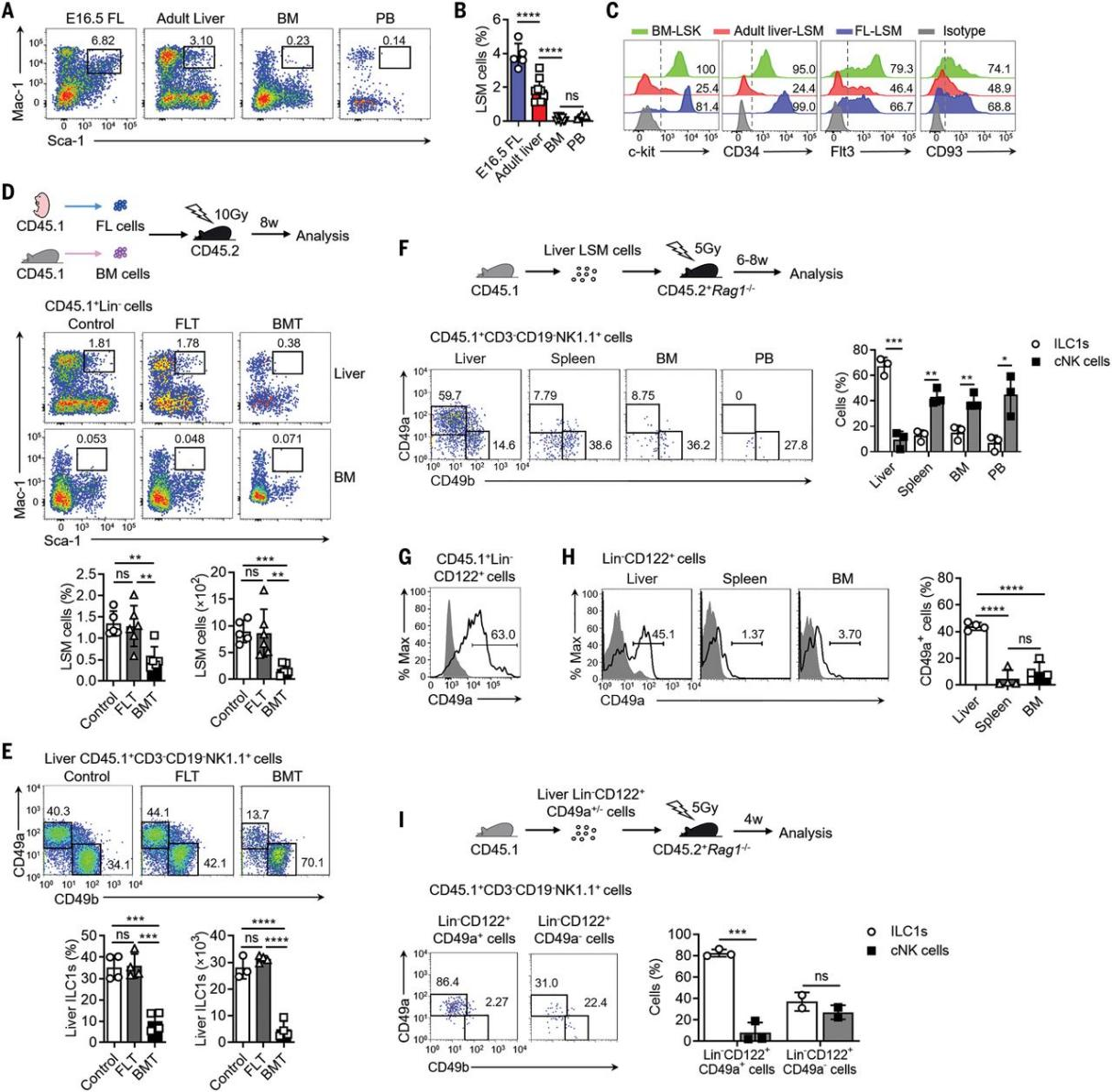
图1. 小鼠肝脏含有造血祖细胞,可产生肝脏内的ILC1s。
2.IFN-γ信号正向调控肝脏ILC1s的数量
作者对Ifng敲除 (GKO) 小鼠和WT小鼠进行检测,发现IFN-γ缺失会特异性导致肝脏中CD3−NK1.1+细胞数量下降,与之前的报道一致[3](Figure 2A, B)。GKO小鼠和Ifngr1敲除 (GRKO) 小鼠肝脏中CD3−NK1.1+细胞的表型分析显示,IFN-γ信号会特异性降低肝脏中CD49a+CD49b− ILC1s的数量和比例 (Figure 2C, E)。挽救实验通过高压尾静脉注射将含有IFN-γ cDNA的质粒递送给GKO小鼠肝脏,伴随着肝脏IFN-γ水平的恢复, GKO小鼠肝脏ILC1s的比例和数量也得以增加(Figure 2G, I)。上述结果表明IFN-γ信号正向调控肝脏ILC1s的数量。
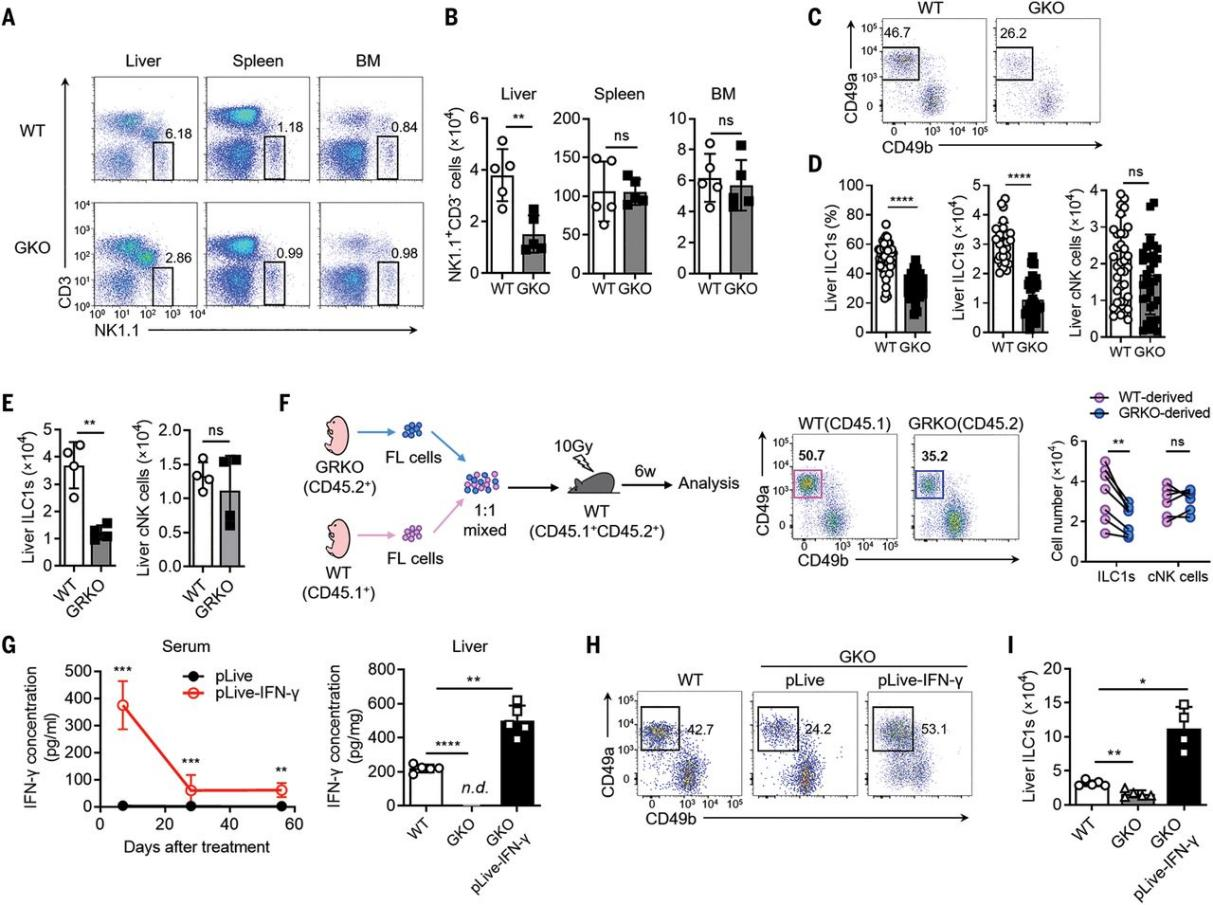
图2. IFN-γ信号通路是肝脏ILC1发育所必需的。
3.LSM细胞向ILC1s的分化依赖IFN-γ信号
作者通过流式检测发现肝脏LSM细胞共表达IFN-γ受体的两个亚单位 (IFN-γR1和IFN-γR2)(Figure 3A, B)。GKO小鼠中LSM细胞的增殖性增强,凋亡不受影响 (Figure 3C, D),而肝脏ILC1s的增殖和凋亡均不受影响 (Figure 3E, F)。因此,IFN-γ信号传导促进了LSM细胞的扩增和分化,但不影响ILC1s的扩增和分化。嵌合体实验中,接受等量GRKO小鼠 (CD45.2+) 和WT小鼠 (CD45.1+) LSM细胞的免疫缺陷小鼠肝脏中,发育而来的ILC1s以CD45.1+为主 (Figure 3G)。上述结果表明IFN-γ信号作用于LSM细胞,以促进其向肝脏ILC1s的分化。
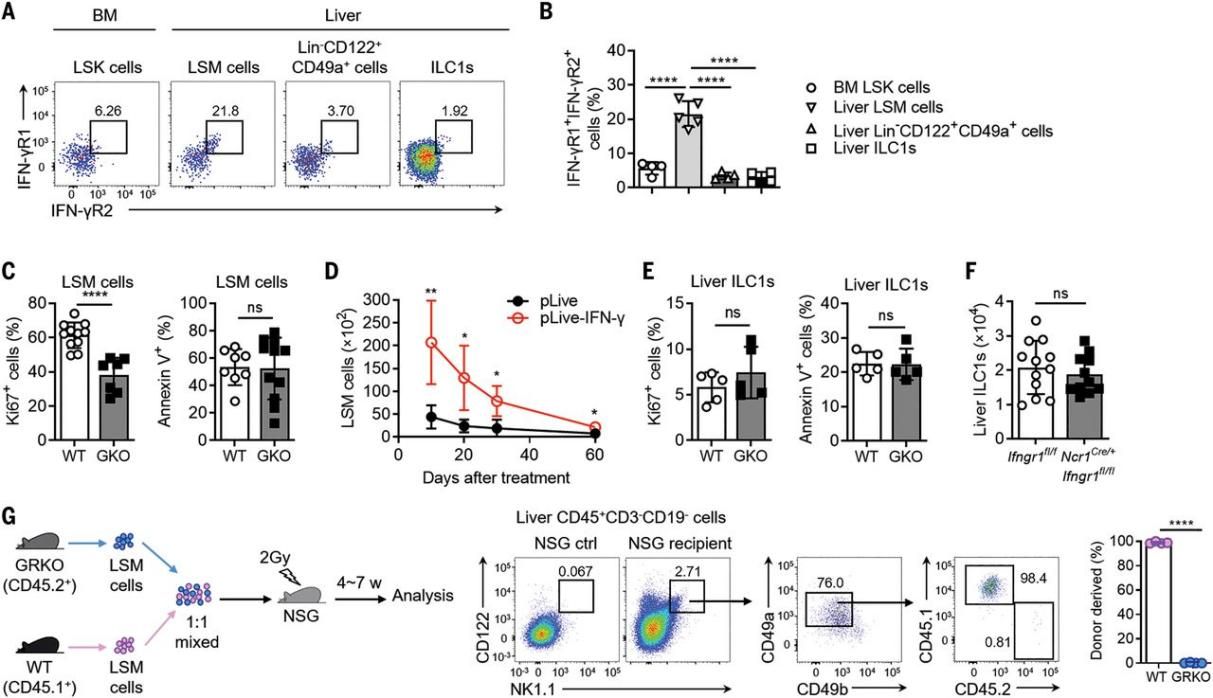
图3. IFN-γ信号通路控制肝内造血祖细胞ILC1的发育。
4.肝脏ILC1s产生的IFN-γ促进其在肝脏中的原位发育
已有研究报道在缺乏cNK细胞的NKp46Cre/+Eomesfl/fl小鼠肝脏中ILC1s的数量不受影响[4],说明促进LSM细胞向ILC1s分化的IFN-γ与T、B和NK细胞无关。作者想要验证肝脏ILCs自身产生的IFN-γ是否参与了肝脏ILC1s的发展。Ncr1Cre/+Ifngfl/fl小鼠的NKp46+细胞特异性缺失Ifng,而NKT细胞不受影响 (Figure 4A, B)。值得注意的是,Ncr1Cre/+Ifngfl/fl小鼠肝脏ILC1s比例和数量降低,而肝脏cNK细胞不受影响 (Figure 4C, D),表明来源于NKp46+细胞的IFN-γ调控ILC1s的产生。结合之前的工作,排除了NK细胞的影响,说明产生有效IFN-γ的NKp46+细胞是ILC1s。
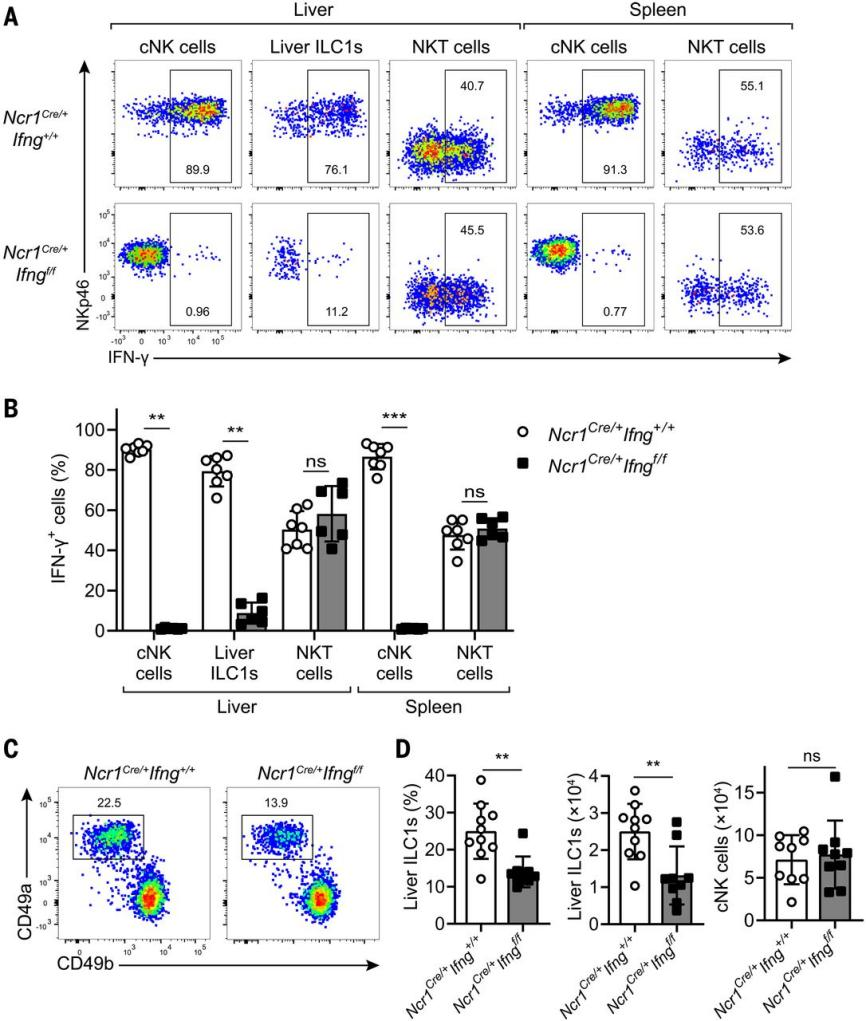
图4. 肝脏ILC1发育过程中NKp46+细胞产生IFN-γ的需求。
总结
在该研究中作者首先证实成年小鼠肝脏存在一群类似于胎肝造血干细胞的Lin−Sca-1+Mac-1+ (LSM)细胞。体内传输实验证明其具有多种淋巴系和髓系细胞发育潜能,并能通过中间过渡阶段细胞,定向分化成肝脏ILC1。课题组还发现成熟ILC1细胞所分泌的IFN-γ可促进肝内LSM细胞扩增及其向ILC1分化。IFN-γ信号缺失导致肝脏ILC1数量减少,而循环NK细胞不受影响。因此,本研究发现成年肝脏存在胎肝来源的造血前体细胞,具有向肝脏驻留ILC1的发育潜能,该过程受肝脏ILC1自分泌的IFN-γ信号正向调控。上述发现揭示了固有淋巴细胞的髓外发育新路径,为阐释肝脏天然免疫优势状态形成原因提供重要理论依据。






