江苏集萃药康生物科技股份有限公司品牌商
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
品牌商
江苏集萃药康生物科技股份有限公司
入驻年限:7 年
- 联系人:
药康生物
- 所在地区:
江苏 南京市 浦口区
- 业务范围:
抗体、细胞库 / 细胞培养、技术服务、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 科研机构
公司新闻/正文
集萃药康和南大林兆宇团队合作发文阐明野鼠染色体替换系可应用于高脂血症研究
1370 人阅读发布时间:2022-12-22 16:12
高脂血症是一种由各种脂质代谢相关因素的血清水平升高引起的疾病,可能会导致冠心病、脑梗塞、糖尿病、非酒精性脂肪肝等多种并发症,严重影响人类健康,因此不论是在基础研究还是药物研发领域都是关注的重点。目前,应用于高脂血症研究的动物模型主要包括HFD诱导模型和经典遗传突变模型。但人类高血脂是一个复杂的病理过程,由多种遗传和环境因素共同引起,传统的诱导模型和单基因改变模型不能完全模拟人类高脂血症。因此,高脂血症的机制研究以及药物开发迫切需要新的高脂血症动物模型。

B6-Chr1BLD小鼠单核苷酸多态性(SNP)分析和转录组学分析
为了进一步探究B6-Chr1BLD小鼠脂代谢相关表型的成因和信号通路,研究人员进行了SNP分析和转录组学分析。大脑WGS分析结果显示了SNP在不同基因组区域的分布模式。在基因间区域(~61.8%)和内含子区域(~35.4%)内发现了大量SNP,而在外显子区域只有约0.69%的SNP。外显子区域中的SNP进一步分为同义SNP(~66.1%)、非同义SNPs(32.5%)、未知SNPs(1.2%)和终止SNPs(~0.2%)。进一步分析了含有非同义SNPs和终止性SNPs的基因。KEGG分析表明,共有5条途径显著富集,包含与与代谢相关的途径(药物代谢细胞色素P450、牛磺酸和低牛磺酸代谢以及维生素B6代谢)。GO分析表明,共有37个GO terms显著富集,包括脂蛋白代谢过程和脂质转运的调节。
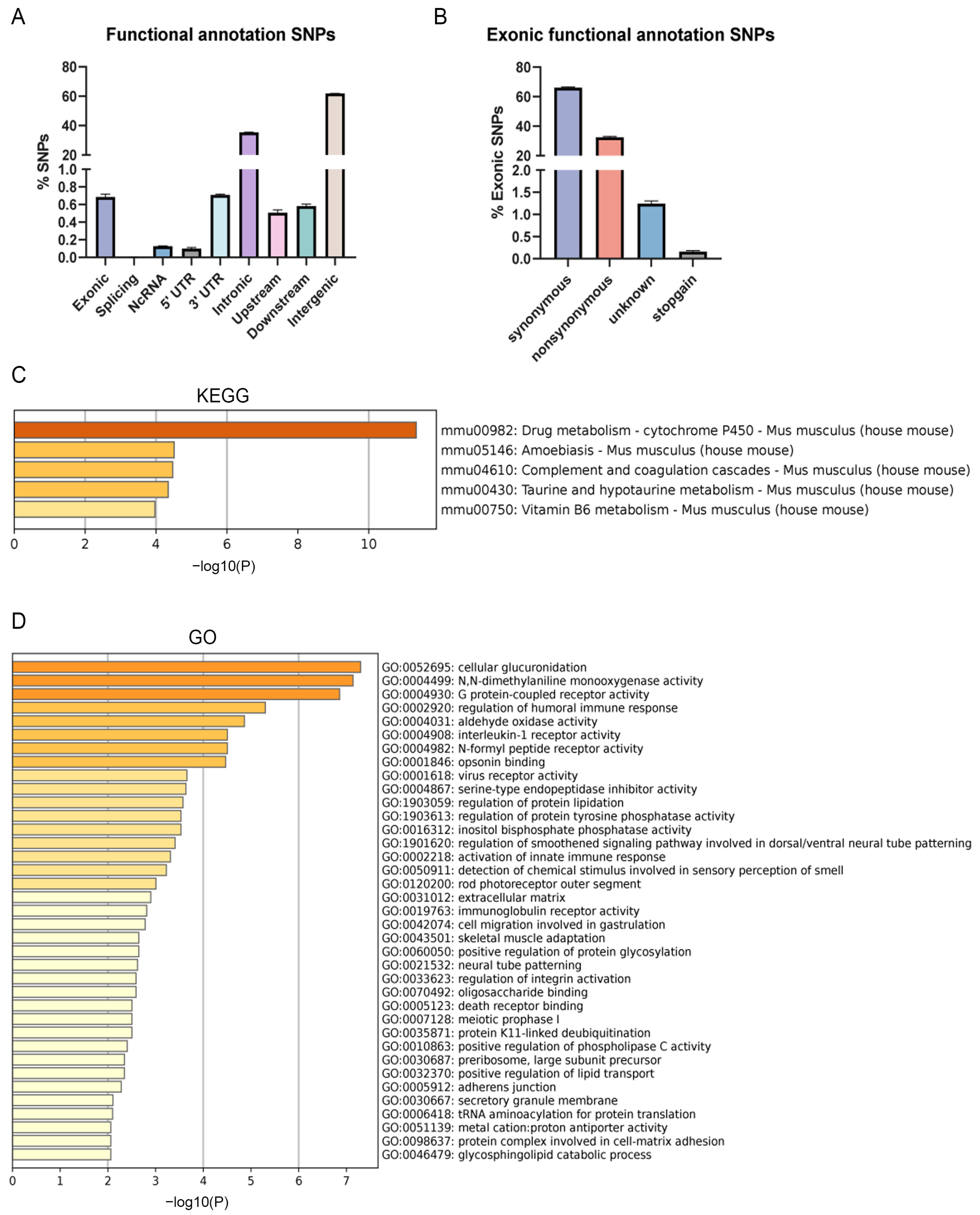
图2. B6-Chr1BLD小鼠的SNP分析
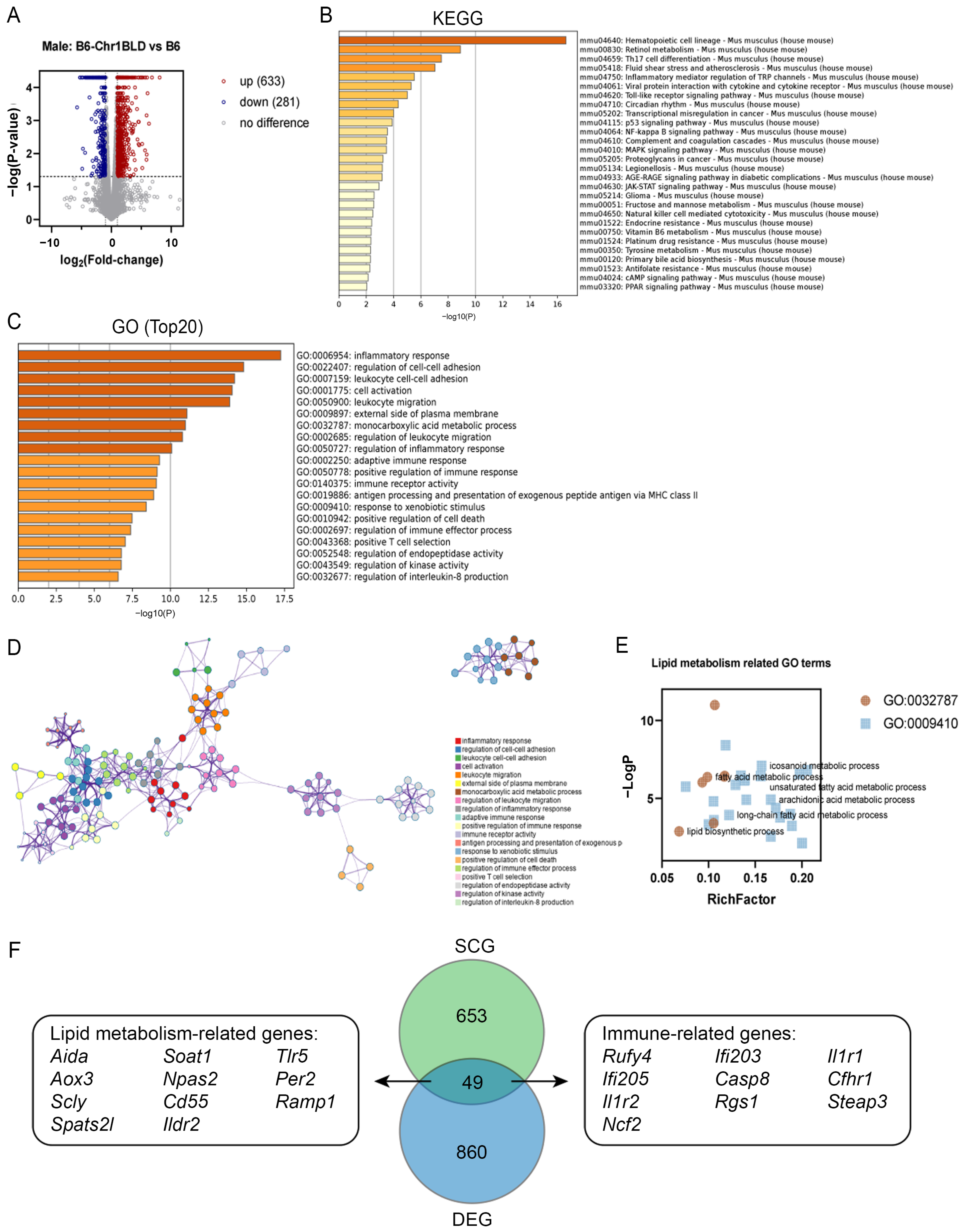
图3. 雄性B6-Chr1BLD小鼠肝脏的转录组分析

近日,集萃药康与南京大学林兆宇课题组合作的一项研究则为我们带来了好消息,其在Metabolites杂志发表了题为Identification of a Chromosome 1 Substitution Line B6-Chr1BLD as a Novel Hyperlipidemia Model via Phenotyping Screening的研究论文,利用野外小鼠染色体替换系进行了体重、血脂、肝脏病理等表型研究,并鉴定了可应用于高脂血症研究的小鼠模型B6-Chr1BLD。
野外小鼠生存在真实的自然环境中,需要适应各种环境压力,因此其具有更多的遗传多样性和表型变异。通过构建野生来源染色体替换系可以大大增加近交系的遗传多样性,但是具体会有哪些表型上的差异,以及如何应用野生来源染色体替换系尚不明确。在这项研究中,研究人员进一步阐明了野生来源1号染色体替换系的代谢表型特征,及其应用于高脂血症研究的可行性。
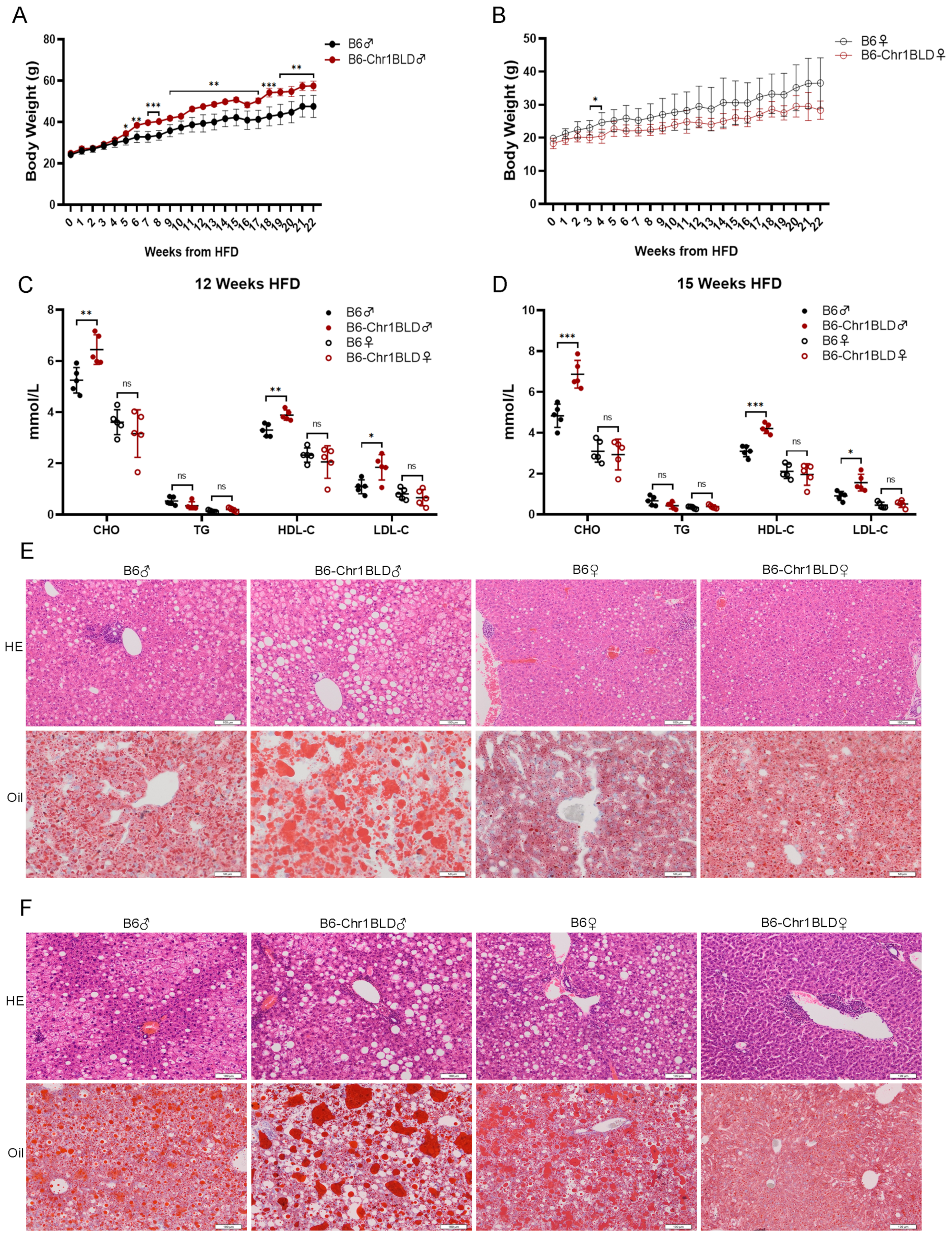
HFD喂养的B6-Chr1BLD小鼠在体重、脂质代谢和肝脏损伤方面表现出明显异常
研究人员分别对8周龄的C57BL/6JGpt和B6-Chr1BLD小鼠用高脂肪饮食(HFD)喂养,结果发现:1)雄性B6-Chr1BLD小鼠的体重在HFD 5周后显著高于对照组,但雌性B6-Chr1B LD小鼠体重仅在HFD 3~4周显著上调;2)在12周HFD和15周HFD时,雄性B6-Chr1BLD小鼠的血清CHO、HDL-C和LDL-C水平显著高于对照小鼠,但雌性小鼠之间没有显著差异;3)H&E染色和油红O染色的结果表明,与对照小鼠相比,雄性B6-Chr1BLD小鼠的肝脏切片在26周HFD和37周HFD时具有更严重的损伤,但雌性B6-Chr1B LD小鼠没有更严重的肝脏炎症和脂质积聚。
结论:HFD喂养的雌性B6-Chr1BLD小鼠仅在体重方面表现出严重表型。HFD喂养的雄性B6-Chr1BLD小鼠在体重、脂质代谢和肝脏损伤方面表现出更严重的高脂血症相关表型,可能作为高脂血症小鼠模型。
野外小鼠生存在真实的自然环境中,需要适应各种环境压力,因此其具有更多的遗传多样性和表型变异。通过构建野生来源染色体替换系可以大大增加近交系的遗传多样性,但是具体会有哪些表型上的差异,以及如何应用野生来源染色体替换系尚不明确。在这项研究中,研究人员进一步阐明了野生来源1号染色体替换系的代谢表型特征,及其应用于高脂血症研究的可行性。
HFD喂养的B6-Chr1BLD小鼠在体重、脂质代谢和肝脏损伤方面表现出明显异常
研究人员分别对8周龄的C57BL/6JGpt和B6-Chr1BLD小鼠用高脂肪饮食(HFD)喂养,结果发现:1)雄性B6-Chr1BLD小鼠的体重在HFD 5周后显著高于对照组,但雌性B6-Chr1B LD小鼠体重仅在HFD 3~4周显著上调;2)在12周HFD和15周HFD时,雄性B6-Chr1BLD小鼠的血清CHO、HDL-C和LDL-C水平显著高于对照小鼠,但雌性小鼠之间没有显著差异;3)H&E染色和油红O染色的结果表明,与对照小鼠相比,雄性B6-Chr1BLD小鼠的肝脏切片在26周HFD和37周HFD时具有更严重的损伤,但雌性B6-Chr1B LD小鼠没有更严重的肝脏炎症和脂质积聚。
结论:HFD喂养的雌性B6-Chr1BLD小鼠仅在体重方面表现出严重表型。HFD喂养的雄性B6-Chr1BLD小鼠在体重、脂质代谢和肝脏损伤方面表现出更严重的高脂血症相关表型,可能作为高脂血症小鼠模型。

图1. HFD喂养的B6-Chr1BLD系显示体重、脂质代谢和肝脏病变显著异常
B6-Chr1BLD小鼠单核苷酸多态性(SNP)分析和转录组学分析
为了进一步探究B6-Chr1BLD小鼠脂代谢相关表型的成因和信号通路,研究人员进行了SNP分析和转录组学分析。大脑WGS分析结果显示了SNP在不同基因组区域的分布模式。在基因间区域(~61.8%)和内含子区域(~35.4%)内发现了大量SNP,而在外显子区域只有约0.69%的SNP。外显子区域中的SNP进一步分为同义SNP(~66.1%)、非同义SNPs(32.5%)、未知SNPs(1.2%)和终止SNPs(~0.2%)。进一步分析了含有非同义SNPs和终止性SNPs的基因。KEGG分析表明,共有5条途径显著富集,包含与与代谢相关的途径(药物代谢细胞色素P450、牛磺酸和低牛磺酸代谢以及维生素B6代谢)。GO分析表明,共有37个GO terms显著富集,包括脂蛋白代谢过程和脂质转运的调节。

图2. B6-Chr1BLD小鼠的SNP分析
使用HFD喂养25周B6-Chr1BLD小鼠和对照小鼠的肝组织样本进行表达谱分析。火山图显示有914个差异表达基因(DEG),包括633个上调基因和281个下调基因。KEGG分析表明,共有28条途径被DEG显著富集,包含与脂质代谢相关的途径(如初级胆汁酸生物合成和PPAR信号通路)、心血管疾病(流体剪切应力和动脉粥样硬化)以及内分泌和代谢疾病(糖尿病并发症中的AGE-RAGE信号通路)等。GO分析表明,除与免疫反应相关的GO terms外,DEG还富含脂质代谢相关功能基因,如脂肪酸代谢过程、脂质生物合成过程、二十烷代谢过程、不饱和脂肪酸代谢进程、花生四烯酸代谢和长链脂肪酸代谢过程。
为了探索含SNPs的基因(SCG)和DEG之间的相关性,研究人员使用Venn图显示了它们之间的重叠。Chr1上的49个共享基因包含11个已报道与脂质代谢相关的基因,包括Aida、Soat1、Tlr5、Aox3、Npas2、Per2、Scly、Cd55、Ramp1、Spats21和Ildr2。这些脂质代谢相关基因可能在雄性B6-Chr1BLD小鼠的异常代谢表型中起到初始和上游调控作用。此外,许多先前的研究表明,高血脂相关疾病与免疫力密切相关[1-3]。研究发现,共享基因中有10个免疫相关基因,包括Rufy4、Ifi203、Il1r1、Ifi205、Casp8、Cfhr1、Il1r2、Rgs1、Steat3和Ncf2。这些基因可能参与雄性B6-Chr1BLD小鼠高脂血症的调节过程。
为了探索含SNPs的基因(SCG)和DEG之间的相关性,研究人员使用Venn图显示了它们之间的重叠。Chr1上的49个共享基因包含11个已报道与脂质代谢相关的基因,包括Aida、Soat1、Tlr5、Aox3、Npas2、Per2、Scly、Cd55、Ramp1、Spats21和Ildr2。这些脂质代谢相关基因可能在雄性B6-Chr1BLD小鼠的异常代谢表型中起到初始和上游调控作用。此外,许多先前的研究表明,高血脂相关疾病与免疫力密切相关[1-3]。研究发现,共享基因中有10个免疫相关基因,包括Rufy4、Ifi203、Il1r1、Ifi205、Casp8、Cfhr1、Il1r2、Rgs1、Steat3和Ncf2。这些基因可能参与雄性B6-Chr1BLD小鼠高脂血症的调节过程。

图3. 雄性B6-Chr1BLD小鼠肝脏的转录组分析
其他1号染色体替换系小鼠(B6-Chr1SJ、B6-Chr1LY、B6-Chr1ZZ2)的表型特征
除了B6-Chr1BLD小鼠,研究人员还初步研究了其他的1号染色体替换系小鼠(B6-Chr1SJ、B6-Chr1LY、B6-Chr1ZZ2)的表型特征,其中雌性小鼠在高脂喂养后具有更显著的脂质代谢紊乱特征,可能是潜在的高血脂研究模型。
该研究通过一系列实验证实 HFD饲喂的雌性B6-Chr1SJ、B6-Chr1LY、B6-Chr1ZZ2和HFD饲喂的雄性B6-Chr1BLD具有显著的高脂血症表型,这些小鼠的体重、肝脏组织中的炎症浸润和脂质积聚水平以及血清中脂质代谢相关因子的释放均显著高于对照小鼠。通过对B6-Chr1BLD系进行RNA-Seq和全基因组测序分析,发现雄性B6-Chr1BLD小鼠在脂质代谢途径中表现出DEG和SNPs富集基因的差异,主要脂质代谢相关基因包括Aida、Soat1、Scly和Ildr2等可能参与了雄性高脂血症B6-Chr1B LD小鼠的病理过程。综上,雌性B6-Chr1SJ、B6-Chr1LY、B6-Chr1ZZ2和雄性B6-Chr1BLD小鼠可以作为基于多基因相互作用的新型高脂血症小鼠模型。
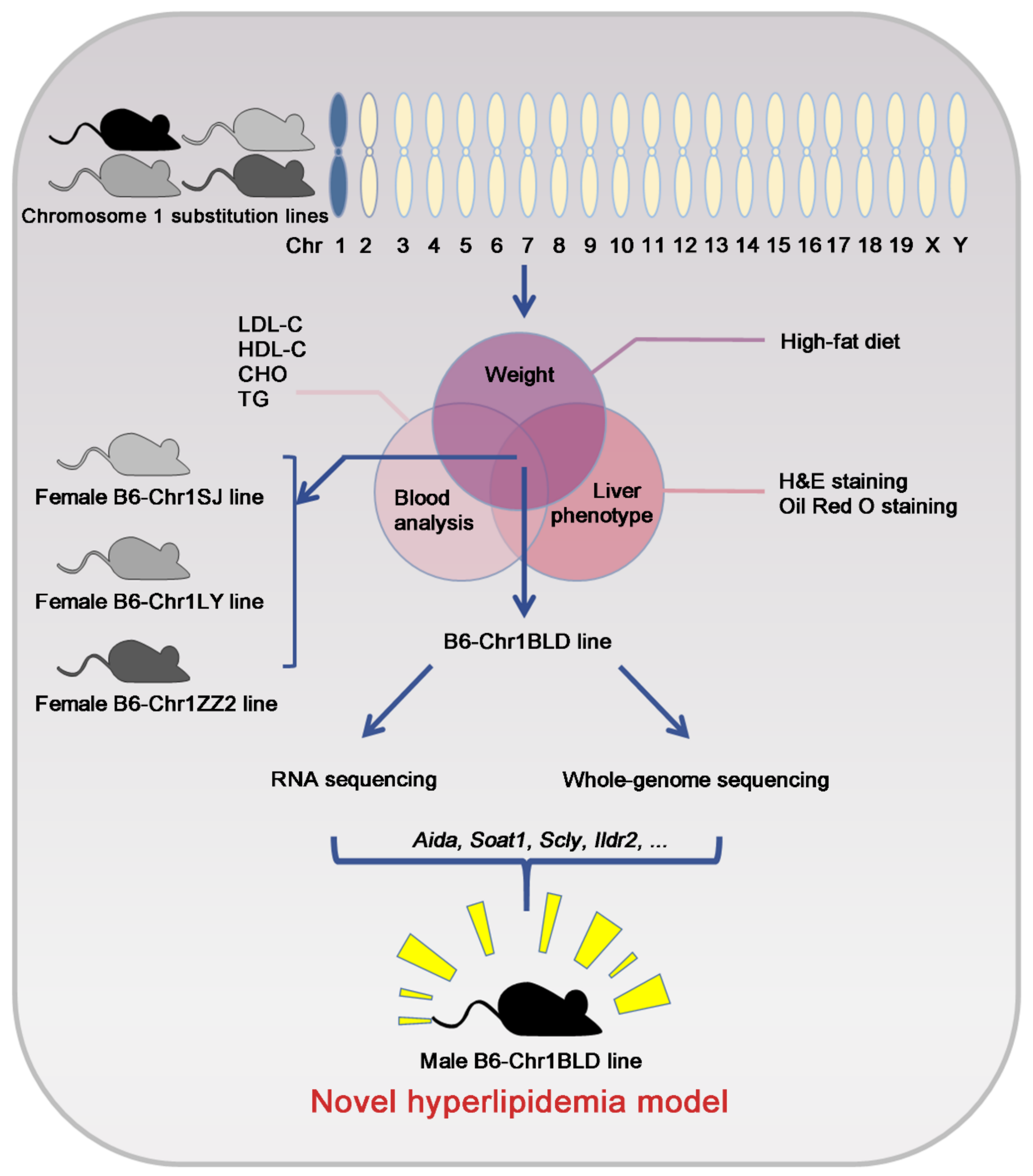
图4. 通过表型筛选鉴定1号染色体替换系作为新的高血脂模型
野鼠替换系应用于临床前研究的展望
在老年人群中,女性高血脂的比例高于男性,而在中青年人群中,男性高血脂的发病率和危害通常高于女性[4-5]。该研究结果佐证了雄性B6-Chr1BLD可能在未来成为男性高脂血症患者的模型。而雌性B6-Chr1SJ、B6-Chr1LY和B6-Chr1ZZ2可能成为女性患者的重要疾病模型,但仍需进一步鉴定老年小鼠的相关代谢表型。
高脂血症在临床上分为三种主要类型,包括TG升高型、CHO升高型以及TG和CHO共同升高型[6]。该研究中的四个Chr 1替换品系可对应到临床的不同分类。HFD喂养的雄性和雌性B6-Chr1SJ系、雄性和雌性的B6-Chr1LY系和雄性B6-Chr1BLD系属于CHO升高型,雌性B6-Chr1ZZ2系属于TG升高型,雄性B6-CHR1 ZZ2则属于TG和CHO均升高的混合型。Chr 1替换品系可以模拟高脂血症的各种类型,可以更好地帮助药物筛选和评价。
与现有的近交系相比,野鼠替换系携带了自然环境导致的突变,具有更丰富的基因多样性和疾病易感性,可以更好地模拟人群。对于多基因导致的复杂疾病,如肥胖、高脂血症、NASH、阿尔兹海默症、系统性红斑狼疮等,野鼠替换系可以作为更合适的机制研究和药物靶点发掘的动物模型。同时,在临床前动物实验中,利用野鼠替换系的基因多样性,可以更好地反映药物对于不同基因特征群体的药效和毒副作用,进而指导临床实验研究。
野鼠明星品系推荐:野鼠750(B6-Chr1YP1)
在C57BL/6JGpt基础上引入了野生小鼠1号染色体从而获得的新模型,具有代谢易感特征,是一个更合适的代谢性疾病研究模型,可应用于肥胖、脂肪肝、血脂代谢紊乱、心血管疾病方向研究,同时可作为一个临床前药物评价模型,用于减重、降脂及NASH治疗药物的药效评价。
模型特点:
参考文献:
除了B6-Chr1BLD小鼠,研究人员还初步研究了其他的1号染色体替换系小鼠(B6-Chr1SJ、B6-Chr1LY、B6-Chr1ZZ2)的表型特征,其中雌性小鼠在高脂喂养后具有更显著的脂质代谢紊乱特征,可能是潜在的高血脂研究模型。
●喂食HFD的雄性B6-Chr1SJ小鼠在体重和脂质代谢方面表现出显著异常,而喂食HFD雌性B6-Chr1SJ小鼠在重量、脂质代谢和肝脏损伤方面表现出明显异常。
●喂食HFD的雄性B6-Chr1LY小鼠仅在脂质代谢方面表现出显著异常,而喂食HFD雌性B6-Chr1RY小鼠在体重、脂质代谢和肝脏损伤方面表现出明显异常。
●喂食HFD的雄性B6-Chr1ZZ2小鼠仅在脂质代谢和肝脏损伤方面表现出显著异常。雌性HFD喂养的B6-Chr1ZZ2小鼠在体重、脂质代谢和肝脏损伤方面表现出显著异常。
总结

图4. 通过表型筛选鉴定1号染色体替换系作为新的高血脂模型
在老年人群中,女性高血脂的比例高于男性,而在中青年人群中,男性高血脂的发病率和危害通常高于女性[4-5]。该研究结果佐证了雄性B6-Chr1BLD可能在未来成为男性高脂血症患者的模型。而雌性B6-Chr1SJ、B6-Chr1LY和B6-Chr1ZZ2可能成为女性患者的重要疾病模型,但仍需进一步鉴定老年小鼠的相关代谢表型。
高脂血症在临床上分为三种主要类型,包括TG升高型、CHO升高型以及TG和CHO共同升高型[6]。该研究中的四个Chr 1替换品系可对应到临床的不同分类。HFD喂养的雄性和雌性B6-Chr1SJ系、雄性和雌性的B6-Chr1LY系和雄性B6-Chr1BLD系属于CHO升高型,雌性B6-Chr1ZZ2系属于TG升高型,雄性B6-CHR1 ZZ2则属于TG和CHO均升高的混合型。Chr 1替换品系可以模拟高脂血症的各种类型,可以更好地帮助药物筛选和评价。
与现有的近交系相比,野鼠替换系携带了自然环境导致的突变,具有更丰富的基因多样性和疾病易感性,可以更好地模拟人群。对于多基因导致的复杂疾病,如肥胖、高脂血症、NASH、阿尔兹海默症、系统性红斑狼疮等,野鼠替换系可以作为更合适的机制研究和药物靶点发掘的动物模型。同时,在临床前动物实验中,利用野鼠替换系的基因多样性,可以更好地反映药物对于不同基因特征群体的药效和毒副作用,进而指导临床实验研究。
集萃药康“野鼠项目”
集萃药康“野鼠项目”是以野外捕捉的小鼠作为遗传材料供体,通过不断与近交系小鼠C57BL/6JGpt交配和筛选,培育出仅有一对染色体来源于野外小鼠,其余19对染色体仍是C57BL/6JGpt来源的全新近交系。获得的染色体替换系根据其表征不同,可应用于代谢、神经、免疫等不同研究领域。野鼠明星品系推荐:野鼠750(B6-Chr1YP1)
在C57BL/6JGpt基础上引入了野生小鼠1号染色体从而获得的新模型,具有代谢易感特征,是一个更合适的代谢性疾病研究模型,可应用于肥胖、脂肪肝、血脂代谢紊乱、心血管疾病方向研究,同时可作为一个临床前药物评价模型,用于减重、降脂及NASH治疗药物的药效评价。
模型特点:
●肥胖:8周龄后呈现自发肥胖表型,摄食量显著增加。
●糖代谢异常:轻度持续血糖升高,胰岛素抵抗。
●●脂代谢异常:8周龄后胆固醇水平随年龄增加显著升高,西方饮食(WD)诱导后进一步升高。
NAFLD/NASH:26周龄时可观察到明显的脂肪肝表型。WD诱导下,进一步加速NASH病症出现,包括脂肪变性、小叶炎症等,同时表现出中等程度纤维化。
参考文献:
1.Moghbeli, M.; Khedmatgozar, H.; Yadegari, M.; Avan, A.; Ferns, G.A.; Ghayour Mobarhan, M. Cytokines and the immune response in obesity-related disorders. Adv. Clin. Chem. 2021, 101, 135–168.
2.Tilg, H.; Adolph, T.E.; Dudek, M.; Knolle, P. Non-alcoholic fatty liver disease: The interplay between metabolism, microbes and immunity. Nat. Metab. 2021, 3, 1596–1607.
3.Schaftenaar, F.; Frodermann, V.; Kuiper, J.; Lutgens, E. Atherosclerosis: The interplay between lipids and immune cells. Curr. Opin. Lipidol. 2016, 27, 209–215.
4.Beyene, H.B.; Olshansky, G.; AA, T.S.; Giles, C.; Huynh, K.; Cinel, M.; Mellett, N.A.; Cadby, G.; Hung, J.; Hui, J.; et al. High-coverage plasma lipidomics reveals novel sex-specific lipidomic fingerprints of age and BMI: Evidence from two large population cohort studies. PLoS Biol. 2020, 18, e3000870.
5.Bakx, J.C.; van den Hoogen, H.J.; Deurenberg, P.; van Doremalen, J.; van den Bosch, W.J. Changes in serum total cholesterol levels over 18 years in a cohort of men and women: The Nijmegen Cohort Study. Prev. Med. 2000, 30, 138–145.
6.Nelson, R.H. Hyperlipidemia as a risk factor for cardiovascular disease. Prim. Care. 2013, 40, 195–211.






