江苏集萃药康生物科技股份有限公司品牌商
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
品牌商
江苏集萃药康生物科技股份有限公司
入驻年限:7 年
- 联系人:
药康生物
- 所在地区:
江苏 南京市 浦口区
- 业务范围:
抗体、细胞库 / 细胞培养、技术服务、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 科研机构
公司新闻/正文
一文梳理系统性红斑狼疮(SLE)创新疗法
2828 人阅读发布时间:2022-12-09 17:37
系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)是一种典型的自身免疫性疾病,以患者血液中存在大量的自身抗体和多器官受累为主要临床特征。全球约有患者500万人,其中中国大陆地区SLE患者群超过100万[1]。SLE表现形式多样,可使用SLE病情活动程度评分(SLEDAI)标准,对系统性红斑狼疮的病情活动程度进行评价和分级。尽管人们对系统性红斑狼疮的研究已经进行了一个多世纪,然而其病因还不明确。大量研究显示遗传、内分泌、感染、免疫异常和一些环境因素均可能引起SLE。
SLE尚无治愈方法,仅能缓解病情。治疗原则为积极控制狼疮活动、改善和阻止脏器损害。目前临床上常用的SLE治疗手段是糖皮质激素联合免疫抑制剂治疗。来自中国系统性红斑狼疮研究协作组(CSTAR)的数据显示,我国84.13%的SLE患者正在使用激素治疗,其中部分患者用于维持治疗的激素剂量偏大,不良反应也随着剂量增加而增多,我国仅有0.76%的SLE患者能够达到无药物治疗疾病完全缓解。因此,SLE的发病机理和各类创新药物/疗法亟需被阐述。
SLE发病机制复杂,药物研发难度大,临床需求远未被满足。我们相信随着不断的科研积累和技术突破,将会有更多SLE创新药物/疗法的出现。
无论是药物开发,还是机制探索,都离不开对动物模型的应用。集萃药康助力SLE创新药物研发,开发了多款SLE研究小鼠模型,提供临床前体内药效服务。
参考文献:
[1] 《2020中国系统性红斑狼疮诊疗指南》
[2] Buang, N., Tapeng, L., Gray, V. et al. Type I interferons affect the metabolic fitness of CD8+ T cells from patients with systemic lupus erythematosus. Nat Commun. 2021 Mar 31;12(1):1980.
[3] Rönnblom L, Pascual V. The innate immune system in SLE: type I interferons and dendritic cells. Lupus. 2008 May;17(5):394-9.
[4] Parodis I, Stockfelt M, Sjöwall C. B Cell Therapy in Systemic Lupus Erythematosus: From Rationale to Clinical Practice. Front Med (Lausanne). 2020 Jul 9;7:316
[5] Schett G, et al. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med. 2022 Oct;28(10):2124-2132
[6] Jin X, Han Y, Wang JQ, Lu L. CAR-T cell therapy: new hope for systemic lupus erythematosus patients. Cell Mol Immunol. 2021 Dec;18(12):2581-2582.
SLE尚无治愈方法,仅能缓解病情。治疗原则为积极控制狼疮活动、改善和阻止脏器损害。目前临床上常用的SLE治疗手段是糖皮质激素联合免疫抑制剂治疗。来自中国系统性红斑狼疮研究协作组(CSTAR)的数据显示,我国84.13%的SLE患者正在使用激素治疗,其中部分患者用于维持治疗的激素剂量偏大,不良反应也随着剂量增加而增多,我国仅有0.76%的SLE患者能够达到无药物治疗疾病完全缓解。因此,SLE的发病机理和各类创新药物/疗法亟需被阐述。

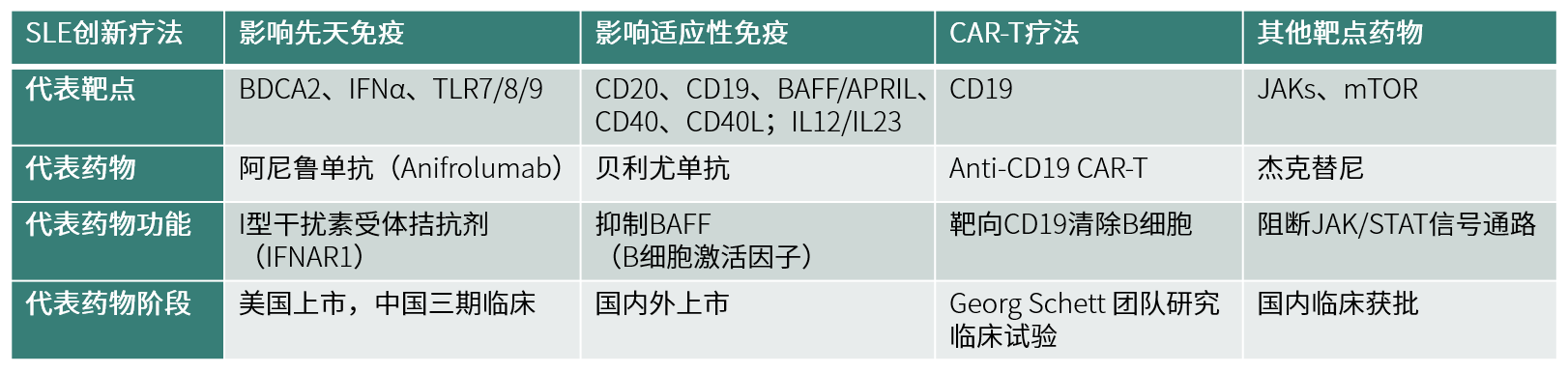
图一:SLE创新药物分类
SLE药物研发的创新之路,需要大量免疫学理论的铺垫和支撑。先天性和适应性免疫系统均在SLE的发病机理中起作用。具体包括抗核抗体组成的免疫复合物、树突状细胞和自身反应性T细胞的激活,以及活化的B细胞分泌的多种自身抗体的过度产生。
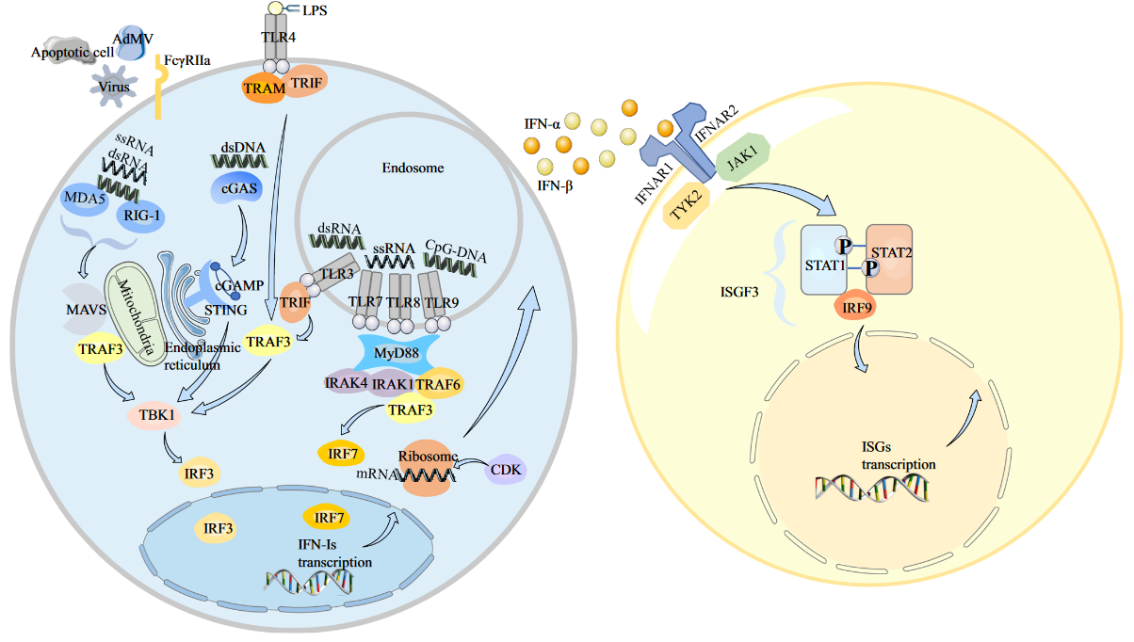
图二:Ⅰ型干扰素(IFN-I)的产生和信号通路[3]
●先天免疫和SLE药物
I型干扰素(IFN-I,主要包括IFNα、β等)是一组非常重要的细胞因子。60%~80%的系统性红斑狼疮患者存在IFN-I高表达特征,而且IFN-I浓度与SLE患者疾病活动指数(SLEDAI)评分呈正相关。IFN-I由先天免疫细胞产生,可在适应性免疫过程中发挥作用,此外,IFN-I也可通过代谢重编程促进CD8+T细胞的死亡,并促进SLE的发病[2]。

图二:Ⅰ型干扰素(IFN-I)的产生和信号通路[3]
阿尼鲁单抗(Anifrolumab)与I型干扰素受体的亚基1(IFNAR1)相结合,进而拮抗IFN-I。临床数据显示,阿尼鲁单抗治疗可以有效降低红斑狼疮患者疾病的严重程度。阿尼鲁单抗于2021年7月在美国上市,获批适应症为成人中重度SLE。该药物目前也在中国开展SLE临床III期试验。
Toll样受体(Toll-like receptors,TLRs)是一种模式识别受体,在先天免疫应答中起着关键作用,同时也是连接先天免疫和适应性免疫的桥梁。TLRs依靠NF-κB和IRFs (interferon-regulatory factors) 两条通路激活下游信号,诱导细胞因子和IFN-I的产生。目前研发进度较快的TLR 7/8抑制剂是默克的enpatoran,该药物正在国内进行二期临床试验。
●适应性免疫和SLE药物
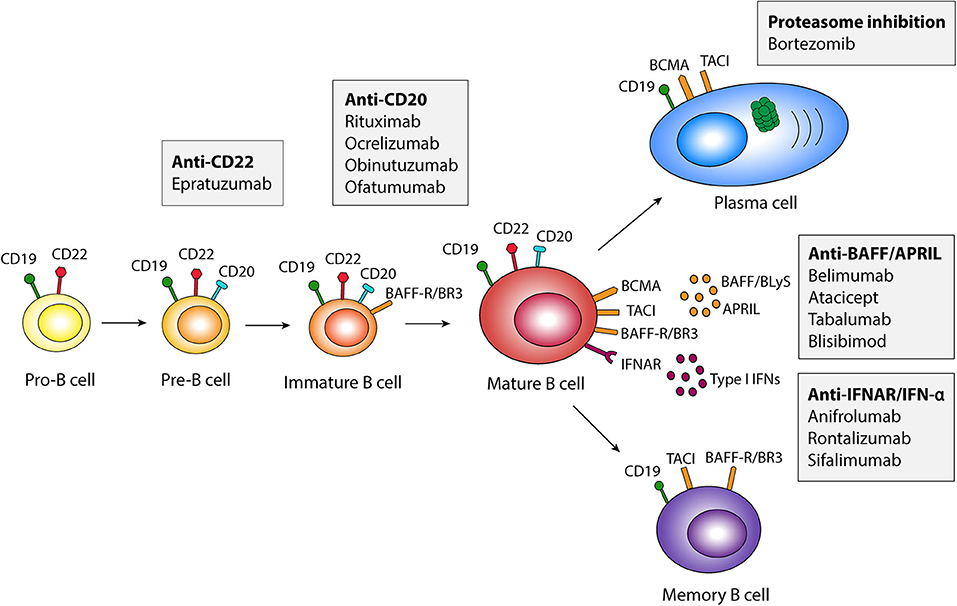
来自SLE患者的T细胞已被证明在体内被激活,并为自身反应性B细胞提供帮助。当前阶段,针对适应性免疫系统的SLE治疗策略中,靶向B细胞的治疗策略更受关注。B细胞和浆细胞(效应B细胞)在SLE发病机制中发挥重要作用,除了分泌自身抗体之外,B细胞还分泌促进炎症的细胞因子。自身抗体的过度产生导致炎症级联反应,最终导致患者器官损伤。

图三:B细胞的成熟和活化[4]
靶向B细胞的治疗策略包括直接杀死B细胞、调节B细胞功能、抑制B细胞生长和存活必需的分子、加速自身抗体清除等。全球SLE靶向生物制剂贝利尤单抗是针对B淋巴细胞刺激因子(BLyS或BAFF)的特异性抑制剂,与血清中的可溶性BLyS有较高的亲和力,进而阻断BLyS与B细胞上的受体结合,抑制B细胞增殖以及B细胞向浆细胞的分化,从而减少血清中B细胞产生的自身抗体,达到治疗SLE的目的。贝利尤单抗于2019年在国内获批上市,打破了国内SLE领域60多年来没有新药的空白。B细胞和浆细胞(效应B细胞)在SLE发病机制中发挥重要作用,靶向B细胞的治疗靶点还包括CD19、CD20、CD40等。●CAR-T细胞治疗SLE
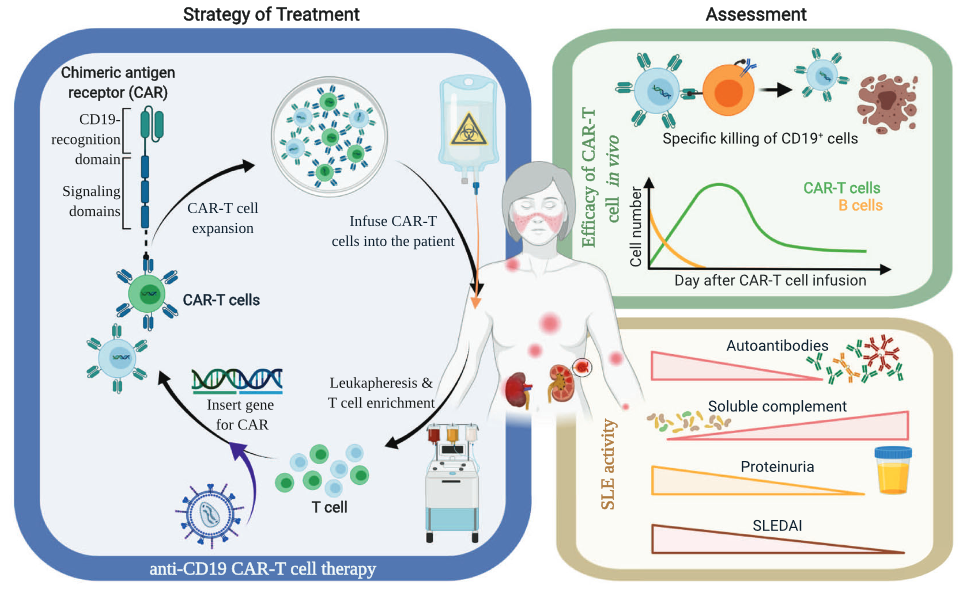
CAR-T细胞治疗在肿瘤领域已经取得显著成效,但在自身免疫病治疗中还处于早期研发阶段。2022年9月,德国埃尔朗根-纽伦堡大学(FAU)的 Georg Schett 教授团队在《Nature Medicine》期刊发表了题为:Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus 的研究论文。研究报告了5名难治性SLE患者经CAR-T治疗后,所有患者病情得到改善,在长达17个月的随访中未出现复发,并且均实现了无药物缓解[5]。2022年11月23日,CAR-T之父Carl H.June 在《Cell》上发表评论文章,对此研究成果表示赞许。希望在不久的将来,CAR-T细胞治疗可以投入临床,使SLE患者受益。

图四:Anti-CD19 CAR-T治疗SLE的技术流程[6]
SLE发病机制复杂,药物研发难度大,临床需求远未被满足。我们相信随着不断的科研积累和技术突破,将会有更多SLE创新药物/疗法的出现。
无论是药物开发,还是机制探索,都离不开对动物模型的应用。集萃药康助力SLE创新药物研发,开发了多款SLE研究小鼠模型,提供临床前体内药效服务。
| SLE创新药物研发小鼠模型推荐 | |
| B6-Trex1-KO小鼠 | B6-hBAFF小鼠 |
|
●3′-5′DNA核酸外切酶(TREX1)敲除小鼠,双链DNA降解障碍,Anti-dsDNA水平高,刺激IFN-I表达。
●适用于先天免疫介导的SLE研究。
|
●人源B细胞激活因子(BAFF)转入B6小鼠基因组,BAFF高表达,Anti-dsDNA水平和B细胞数量显著升高。
●适用于B细胞介导的SLE研究。
|
| 降植烷(Pristane)诱导SLE | 诱导免疫重建模型 |
|
●引起炎症,增强免疫反应。
●可配合使用基因人源化小鼠进行诱导,评价靶点特异性药物。
|
●免疫缺陷小鼠重建人源免疫系统。
●可用于评价CAR-T细胞疗法。
|
参考文献:
[1] 《2020中国系统性红斑狼疮诊疗指南》
[2] Buang, N., Tapeng, L., Gray, V. et al. Type I interferons affect the metabolic fitness of CD8+ T cells from patients with systemic lupus erythematosus. Nat Commun. 2021 Mar 31;12(1):1980.
[3] Rönnblom L, Pascual V. The innate immune system in SLE: type I interferons and dendritic cells. Lupus. 2008 May;17(5):394-9.
[4] Parodis I, Stockfelt M, Sjöwall C. B Cell Therapy in Systemic Lupus Erythematosus: From Rationale to Clinical Practice. Front Med (Lausanne). 2020 Jul 9;7:316
[5] Schett G, et al. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med. 2022 Oct;28(10):2124-2132
[6] Jin X, Han Y, Wang JQ, Lu L. CAR-T cell therapy: new hope for systemic lupus erythematosus patients. Cell Mol Immunol. 2021 Dec;18(12):2581-2582.






