江苏集萃药康生物科技股份有限公司品牌商
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
品牌商
江苏集萃药康生物科技股份有限公司
入驻年限:7 年
- 联系人:
药康生物
- 所在地区:
江苏 南京市 浦口区
- 业务范围:
抗体、细胞库 / 细胞培养、技术服务、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 科研机构
公司新闻/正文
自发「骨质疏松」模型,了解一下
639 人阅读发布时间:2022-10-26 13:58
骨质疏松症(OP)是一种以骨量降低、骨组织微结构破坏,导致骨脆性增加、骨强度下降,易发生骨折为特征的全身性代谢骨病。骨质疏松症已被世界卫生组织列为仅次于心血管疾病的第二大危害人类健康的疾病,被称为“沉默的杀手”。相关研究报告显示,中国是世界上骨质疏松症患者最多的国家,约有9000万人罹患此病,其发病率与年龄息息相关。OP的危害主要为易发骨折、骨质疏松性骨折导致的残疾、心肺功能障碍等,极大地影响老年人生活质量。
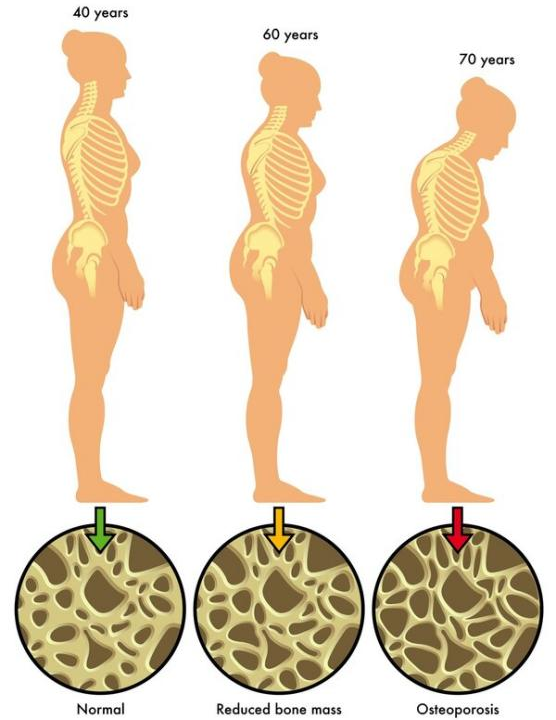
图1. 不同年龄阶段OP表型
OP的分类和分型
OP发病受多重因素影响,包括遗传、激素、营养、年龄、生活习惯及免疫学等。临床常见的OP根据病因可分为原发性、继发性、特发性OP三类[1]。
表1. Ⅰ型与Ⅱ型OP的特点
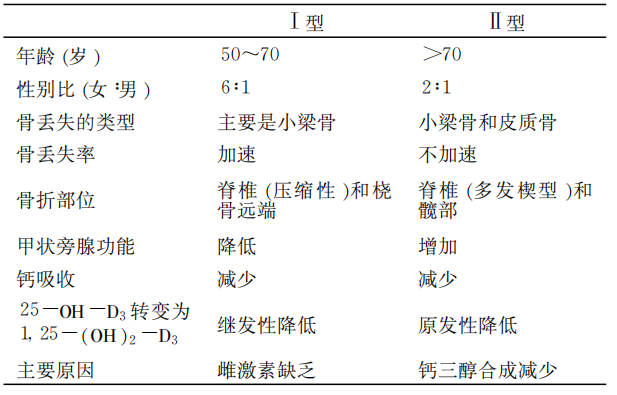
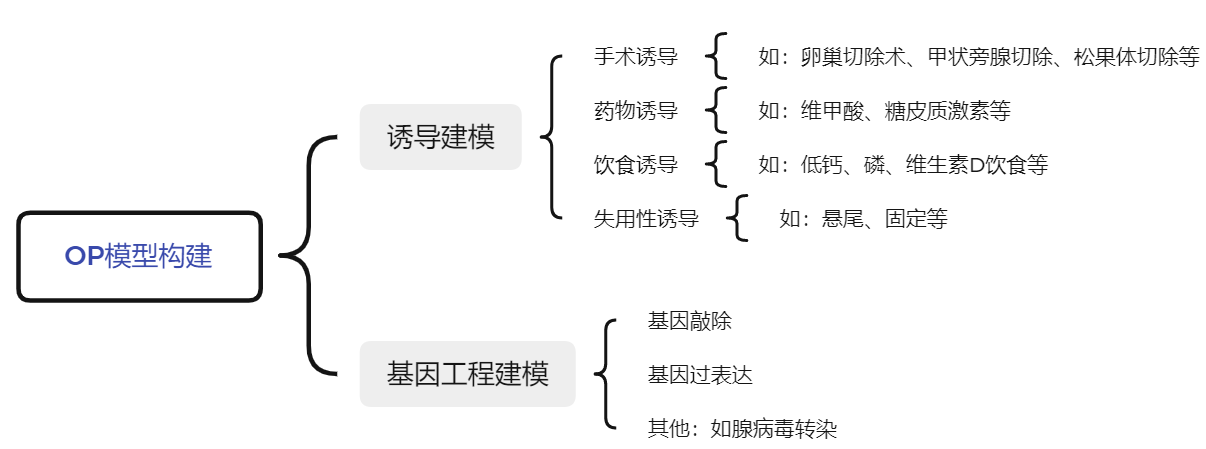
图2. OP模型构建方式
基于基因编辑技术构建自发OP模型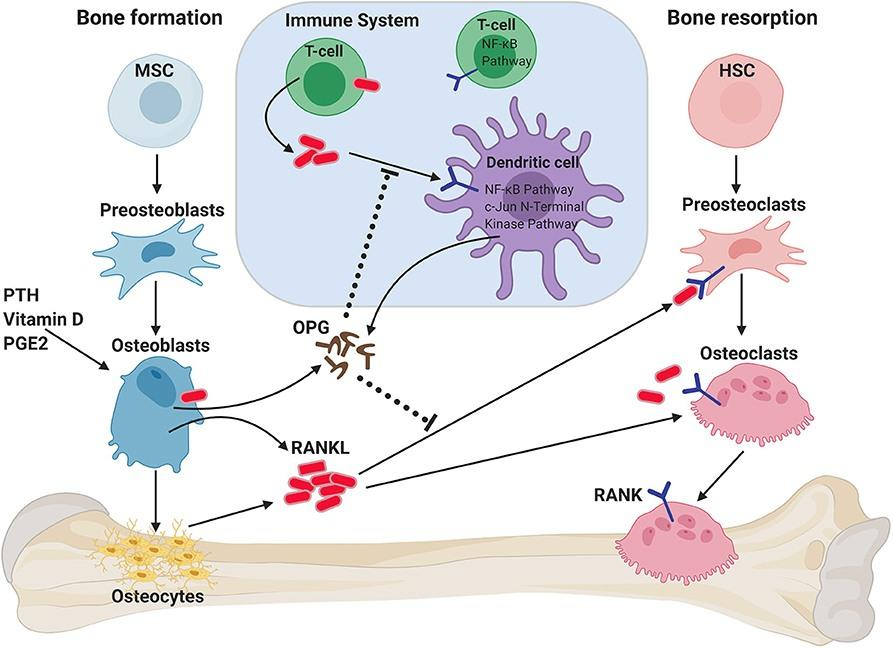
图3. OPG/RANK/RANKL在骨稳态中的作用
表2. 相关模型推荐
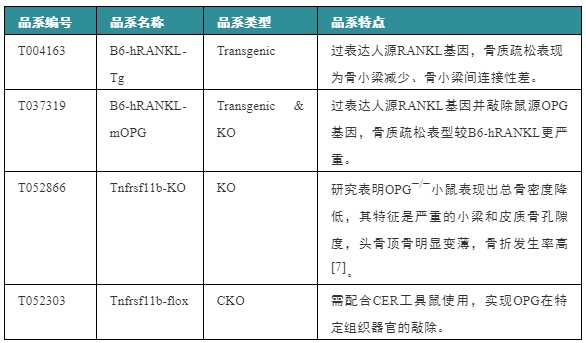
注:Tnfrsf11b为opg的官方名
表3. 相关模型推荐
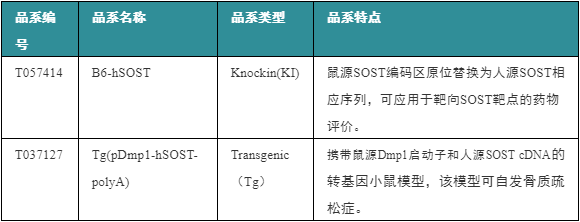

图1. 不同年龄阶段OP表型
OP的分类和分型
OP发病受多重因素影响,包括遗传、激素、营养、年龄、生活习惯及免疫学等。临床常见的OP根据病因可分为原发性、继发性、特发性OP三类[1]。
1.原发性OP
原发性OP是临床最常见的类型(约占80%),又分为Ⅰ型高转换型OP(以骨吸收增加为主,常见于绝经后女性)和Ⅱ型低转换型OP(以骨形成减少为主,常见于老年人)。
表1. Ⅰ型与Ⅱ型OP的特点

2.继发性OP
继发性OP是指由于某些疾病或某些原因诱发的骨质疏松,根据发病原因可分为先天性OP、内分泌性OP、营养缺乏性OP、血液系统性OP、药物性OP等等。
3.特发性OP
特发性OP包括:青少年OP、青壮年OP以及妊娠、哺乳期OP或骨量减少。
常见的OP模型构建方式
关于OP的研究(发病机制、药物筛选、防治手段等)都离不开动物模型的构建和应用[2]。由于OP发病机制较为复杂、药物作用机制与作用靶点不同,因此抗骨质疏松症药物药效学研究过程中动物模型的选择有所不同。
理想的OP模型至少需要符合以下几点[3]: 一是简便,即建模方法简单,周期短,建模过程具有较强的可控性和可操作性; 二是经济,即建模费用适中,可大批量应用; 三是相似性好,能较好地模拟OP发生和发展的过程。经过长期实践探索,OP 研究中模式动物种类繁多,造模方法可概括为诱导建模和基因工程建模两类。
理想的OP模型至少需要符合以下几点[3]: 一是简便,即建模方法简单,周期短,建模过程具有较强的可控性和可操作性; 二是经济,即建模费用适中,可大批量应用; 三是相似性好,能较好地模拟OP发生和发展的过程。经过长期实践探索,OP 研究中模式动物种类繁多,造模方法可概括为诱导建模和基因工程建模两类。

图2. OP模型构建方式
诱导建模根据诱导原理和方式的不同可分为手术诱导(卵巢切除术、甲状旁腺切除、松果体切除等)、药物诱导(如维甲酸、糖皮质激素等)、饮食诱导(如低钙、磷、维生素D饮食等)、失用性诱导(如悬尾、固定等)等;基因工程动物主要包括基因敲除模型(全身性敲除、条件性敲除)、基因过表达模型以及腺病毒转染等方式构建的其他模型。
基于基因编辑技术构建自发OP模型
基于OPG/RANK/RANKL信号通路构建的基因编辑模型
人体骨组织处于不断重建中,成骨细胞骨形成与破骨细胞骨吸收之间的联系是骨代谢平衡的必要条件,而骨保护素(OPG)/核因子κβ受体活化因子(RANK)/核因子κβ受体活化因子配体(RANKL)信号通路是成骨细胞与破骨细胞之间通讯的重要桥梁[4]。

图3. OPG/RANK/RANKL在骨稳态中的作用
RANKL(TNFSF11)是TNF超家族成员,参与免疫调节及骨代谢(形成/吸收),是破骨细胞分化及成熟的重要激活因子。RANKL通过与RANK结合在调控破骨细胞的形成及其在骨重建中发挥重要作用。而OPG通过与RANKL结合,阻断RANK与RANKL结合,从而抑制骨吸收,维持骨代谢平衡[4-5]。因此,过表达RANKL或下调OPG水平可能会导致破骨细胞过度活化而出现OP。
OPG/RANK/RANKL信号系统除调节骨代谢平衡外,也参与细胞增殖、血管硬化、肿瘤骨转移、炎症和骨免疫等多种生理生化过程[6]。因此,靶向OPG、RANKL等靶点开发治疗骨质疏松及其他骨代谢疾病治疗药物具有重要意义。
表2. 相关模型推荐

注:Tnfrsf11b为opg的官方名
基于Wnt及BMP信号通路构建的基因编辑模型
在骨形成的过程中,最重要的便是Wnt及BMP信号通路。BMP(bone morphogenetic protein,骨形态发生蛋白)是转化生长因子-beta(TGF-β)超家族成员,广泛存在于人和动物的骨组织中,由成骨细胞产生,结合膜上I型或II型BMP受体,将信号转导至Smad家族核因子实现信号通路的活化,进而激活下游成骨细胞特异性转录因子runx2、osterix等并上调其表达[8]。Wnt是是F-跨膜卷曲蛋白受体家族(FZD)的配体,在成骨细胞中,通过与LRP-5/6结合,改变膜受体构象将信号传入胞内,进而激活β-catenin等下游蛋白,促进骨髓间质干细胞向成骨细胞分化并抑制其凋亡[9]。
通过对Wnt及BMP信号通路的进一步研究发现,硬骨素(SOST)是一种高度保守的主要由骨细胞分泌的糖蛋白,是骨形成的重要负调控因子[10-12]。过表达SOST将通过抑制Wnt和BMP信号通路来影响成骨细胞的分化和增殖,从而抑制骨形成。骨形成受到抑制造成的骨重塑平衡被破坏,将导致小鼠产生OP[12-14]。
目前,FDA批准的SOST单抗Romosozumab在Ⅰ型与Ⅱ型OP患者中都显示出较好的疗效,不仅能抑制骨吸收,更能促进新骨形成[15]。然而,目前Romosozumab仍存在在防治股骨骨折时效果不如预期,副作用较大的问题影响药物使用。因此,开发更安全、高效的SOST靶向药物也成了目前骨质疏松药物开发市场的重要目标。
表3. 相关模型推荐

其他基因编辑模型
Klotho基因编码一种跨膜蛋白,其中含有多种成纤维细胞生长因子(FGH)受体,且是FGF23的复合受体。敲除Klotho基因获得的klotho-/-小鼠是一种快速老化的动物模型,其成骨细胞的数量减少,骨矿化作用受阻,能成功模拟老年性OP的特点[16]。
老化星形胶质细胞特异性诱导物(OASIS)在成骨细胞中显著表达。敲除该基因获得的oasis-/- 小鼠骨形成受抑制,骨折风险增加,有望成为一种新型OP模型,用于药物治疗骨量减少的新药开发[17]。
除此之外,还有很多与骨质疏松相关的基因,通过构建基因敲除或过表达模型等,可以更好研究基因功能和致病机制,为疾病的治疗和预防提供有利的依据。
参考文献:
- 李险峰. 骨质疏松症的分类和分型. 中国全科医学. 2005, (16).
- 薛丽香, 张凤珠, 孙瑞娟, 等.我国疾病动物模型的研究现状和展望.中国科学: 生命科学,2014,44( 9) : 851-861.
- 孙凯, 魏戌, 朱立国, 等. 病证结合模式下骨质疏松症实验动物模型的研究进展. 中国骨质疏松杂志, 2019, 25 ( 9) :1340-1344.
- 李小娜. OPG/RANK/RANKL信号通路研究进展.河南医学研究, 2014.
- Rinotas, Vagelis, et al. Novel genetic models of osteoporosis by overexpression of human RANKL in transgenic mice. Journal of Bone and Mineral Research 29.5 (2014): 1158-1169.
- 屈晓龙, 蒋涛. OPG-RANKL-RANK信号系统与骨质疏松治疗的研究进展. 生命科学. 2018, 30(07).
- Bucay, Nathan, et al. Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification. Genes & development 12.9 (1998): 1260-1268.
- Winkler DG, Sutherland MK, Geoghegan JC, et al. Osteocyte control of bone formation via sclerostin, a novel BMP antagonist [J]. The EMBO Journal Vol. 22 No. 23 pp. 6267-6276, 2003.
- Baron R, Rawadi G. Wnt signaling and the regulation of bone mass. Curr Osteoporos Rep. 2007 Jun;5(2):73-80.
- Balemans W, Ebeling M, Patel N, et al. Increased bone density in sclerosteosis is due to the deficiency of a novel secreted protein (SOST). Human Molecular Genetics 10.5(2001):537-543.
- Brunkow ME, Gardner JC, Ness JV, et al. Bone Dysplasia Sclerosteosis Results from Loss of the SOST Gene Product, a Novel Cystine Knot–Containing Protein. The American Journal of Human Genetics 68.3(2001):0-589.
- Wu MG, Chen GQ and Li YP. TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Research 4(2016):16009.
- Rhee Y, Allen MR, Condon K, et al. PTH receptor signaling in osteocytes governs periosteal bone formation and intracortical remodeling. Journal of Bone & Mineral Research. 26.5 (2011):1035-1046.
- Tu XL, Rhee Y, Condon KW, et al. Sost downregulation and local Wnt signaling are required for the osteogenic response to mechanical loading. Bone 50.1(2012):0-217.
- McClung and R. Michael . Romosozumab for the treatment of osteoporosis. Osteoporosis and Sarcopenia(2018):S2405525518300062.






