江苏集萃药康生物科技股份有限公司品牌商
7 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 1.7000000000000002
- 0.7000000000000002
品牌商
江苏集萃药康生物科技股份有限公司
入驻年限:7 年
- 联系人:
药康生物
- 所在地区:
江苏 南京市 浦口区
- 业务范围:
抗体、细胞库 / 细胞培养、技术服务、试剂、耗材、实验室仪器 / 设备
- 经营模式:
生产厂商 代理商 科研机构
公司新闻/正文
集萃成章|Nature研究成果揭示降胆固醇全新策略
1121 人阅读发布时间:2022-08-17 16:07
胆固醇是动物组织细胞必不可少的重要物质,不仅参与细胞膜的形成,也是合成胆汁酸、维生素D以及甾体激素的原料。机体通过协调胆固醇吸收、合成和外排从而维持动态平衡,一旦这种平衡被打乱,就可能引起各种疾病[1]。
目前,高胆固醇引发的心血管疾病越来越多,已经成为心血管疾病主要的危险因素[1,2]。降胆固醇是预防和治疗心血管疾病的必要手段。现有的降胆固醇药物主要包括他汀类药物、依折麦布、PCSK9抑制剂等,虽然都能不同程度的降低血脂,但是也存在一定的副作用和局限性[3],如:他汀类药物和PCSK9抑制剂使血液中胆固醇进入肝脏,改变胆固醇分布,有增加肝脏负担的风险;依折麦布抑制胆固醇吸收,降脂幅度有限。
人体细胞很难高效降解胆固醇分子,如能将胆固醇外排出人体将是理想的降脂策略,但目前没有药物能够通过直接促进胆固醇分解代谢或外排来降低胆固醇。早前研究发现功能丧失的去唾液酸糖蛋白受体1 ( ASGR1) 变体与低胆固醇和降低心血管疾病风险有关[4]。ASGR1仅在肝脏中表达并介导血液中去唾液酸糖蛋白的内化和在溶酶体中的降解[5]。然而,ASGR1影响胆固醇代谢的机制尚不清楚。
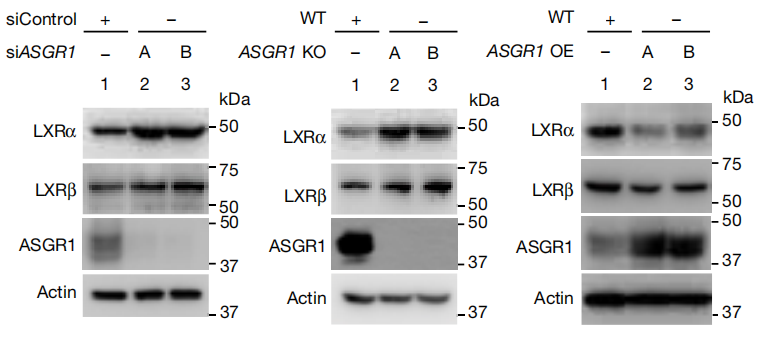
已有研究报道,BRCA1/BARD1复合体作为泛素连接酶介导LXR的泛素化降解[6]。本研究进一步的实验,发现ASGR1缺失会减少BRCA1和BARD1,来增加LXRα的表达。
虽说ASGR1缺失会导致LXRα升高,但其带来的代谢改善是否归因于LXRα升高呢?
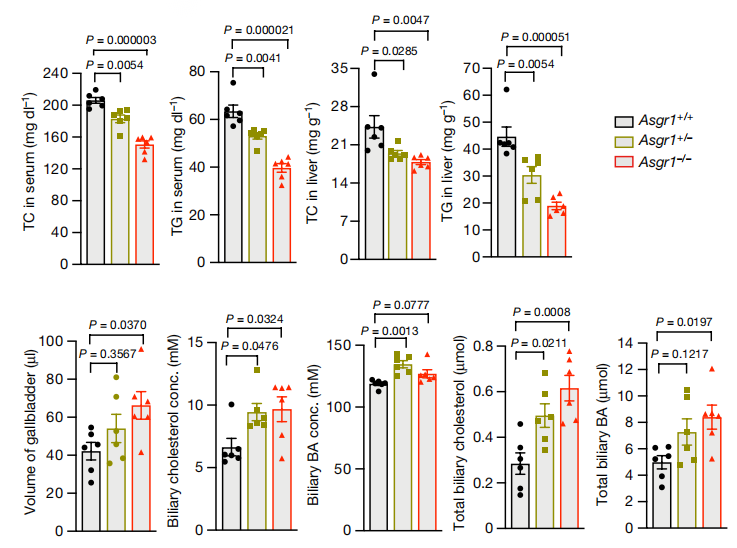
综上,本研究提供了一种独特的降胆固醇方式,抑制ASGR1会增加胆汁和粪便中的胆固醇外排,ASGR1的功能丧失变体与降低非HDL胆固醇和减少复发性心血管疾病相关,这提示抑制ASGR1是治疗心血管疾病安全有效的方法。
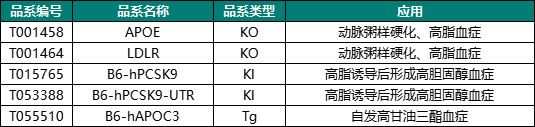
胆固醇相关机制研究及药物开发需要动物模型支撑,集萃药康基于自主搭建的基因编辑平台构建出多种高胆固醇血症研究模型,助力基础科研和药物研发。
目前,高胆固醇引发的心血管疾病越来越多,已经成为心血管疾病主要的危险因素[1,2]。降胆固醇是预防和治疗心血管疾病的必要手段。现有的降胆固醇药物主要包括他汀类药物、依折麦布、PCSK9抑制剂等,虽然都能不同程度的降低血脂,但是也存在一定的副作用和局限性[3],如:他汀类药物和PCSK9抑制剂使血液中胆固醇进入肝脏,改变胆固醇分布,有增加肝脏负担的风险;依折麦布抑制胆固醇吸收,降脂幅度有限。
人体细胞很难高效降解胆固醇分子,如能将胆固醇外排出人体将是理想的降脂策略,但目前没有药物能够通过直接促进胆固醇分解代谢或外排来降低胆固醇。早前研究发现功能丧失的去唾液酸糖蛋白受体1 ( ASGR1) 变体与低胆固醇和降低心血管疾病风险有关[4]。ASGR1仅在肝脏中表达并介导血液中去唾液酸糖蛋白的内化和在溶酶体中的降解[5]。然而,ASGR1影响胆固醇代谢的机制尚不清楚。

2022年8月3日,武汉大学生命科学学院、泰康生命医学中心宋保亮教授实验室在Nature发表了文章“Inhibition of ASGR1 decreases lipid levels by promoting cholesterol excretion”(抑制ASGR1蛋白通过促使胆固醇外排而降低脂质水平)。该研究揭示了抑制ASGR1蛋白促使胆固醇外排入胆汁,进一步通过粪便排出机体,从而降低血液和肝脏中的脂质水平,对动脉粥样硬化和脂肪肝有明显疗效。
(本研究所采用的Asgr1和Ldlr敲除小鼠,均由集萃药康提供。)
主要结果
为了揭示ASGR1影响胆固醇代谢的机制,研究团队首先通过RNA-Seq分析了ASGR1敲低的细胞中发生变化的通路,发现LXR靶基因(包括ABCG5、ABCG8和ABCA1)高度富集,而LXR靶基因则是在调控胆固醇平衡方面起重要作用的一类基因。研究发现,过表达ASGR1会减少LXR蛋白水平,抑制LXR靶基因的表达,并且在ASGR1缺失的小鼠中,发现血液中和肝脏中脂质水平大大降低,其胆汁中胆固醇显著增加。这表明ASGR1缺失会增加LXRα的表达并通过引起胆固醇外排而降低血液中和肝脏中脂质水平。


图1:ASGR1缺乏会增加LXRα的表达并促进胆固醇外排并降低血脂水平
已有研究报道,BRCA1/BARD1复合体作为泛素连接酶介导LXR的泛素化降解[6]。本研究进一步的实验,发现ASGR1缺失会减少BRCA1和BARD1,来增加LXRα的表达。
虽说ASGR1缺失会导致LXRα升高,但其带来的代谢改善是否归因于LXRα升高呢?
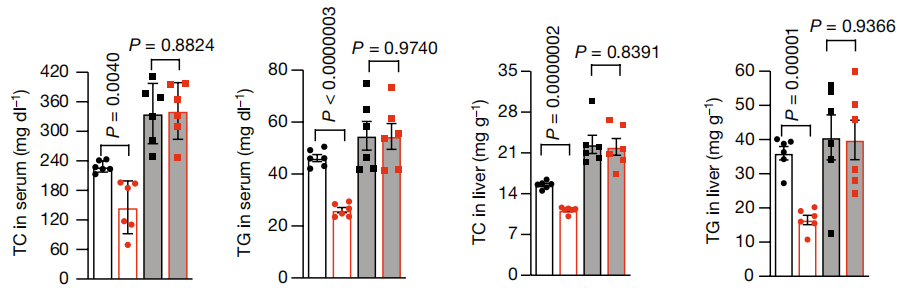
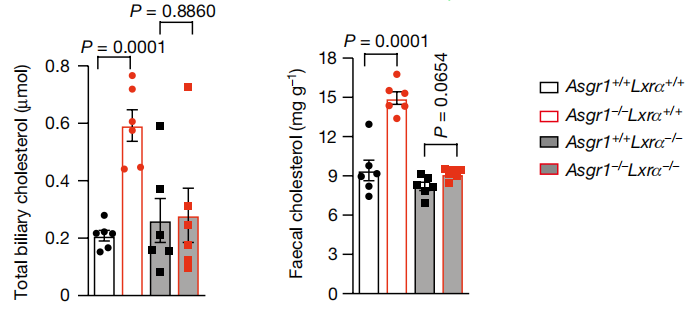
为解决这一疑问,研究人员分别采用Asgr1、Lxrα单敲和双敲的小鼠进行了一系列验证。结果发现当LXRα不表达时,ASGR1缺失未能增加Abcg5、Abcg8、Abca1和Cyp7a1的表达;且此时无论ASGR1是否缺失,其血液中和肝脏中脂质水平较高并且相对一致,而胆汁中和粪便中胆固醇水平则相对较低且一致。这表明ASGR1缺失带来的代谢改善依赖于LXRα。


图2:Asgr1缺失带来的代谢改善依赖于LXRα
到这里,大家肯定也会猜想ASGR1到底是通过什么样的通路调控脂代谢的呢?
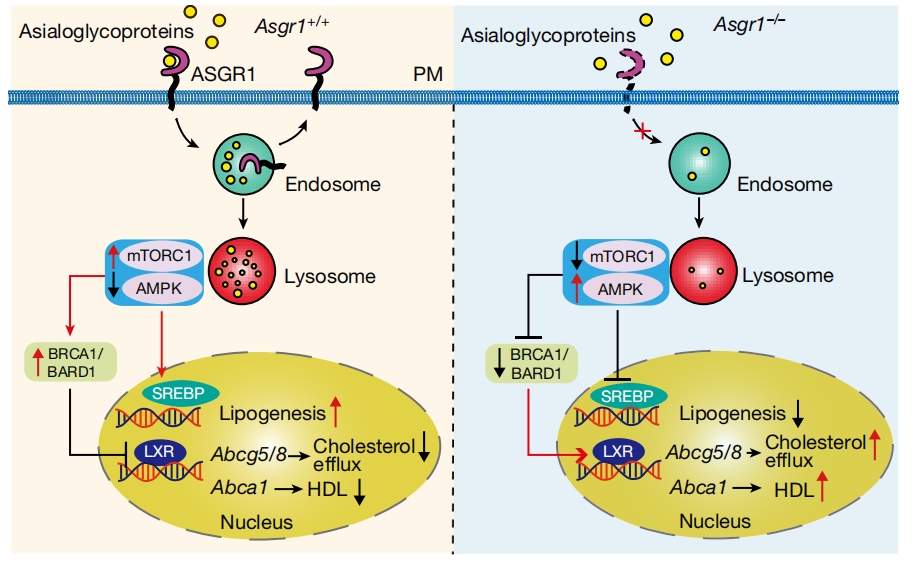
据已知研究报道,mTORC1和AMPK是感知细胞营养和控制新陈代谢的两个主要调节器[7,8]。基于此,该研究也揭示了mTORC1和AMPK可以被ASGR1所调控。经过多方面实验,证实了ASGR1通过mTOR/AMPK→BRCA1/BARD1→LXR→ABCG5/G8这一通路调控脂代谢的工作模式。
(图3左)去唾液酸糖蛋白(配体)与位于细胞膜上的ASGR1结合,经过内吞途径,进入到溶酶体中,被降解成游离氨基酸等营养物质激活溶酶体表面的mTORC1及抑制AMPK。增加下游泛素连接酶BRCA1/BARD1的蛋白水平,促进LXR蛋白降解。
(图3右)当ASGR1缺失或被抑制时,糖蛋白内吞降解减少,溶酶体内的氨基酸水平降低,导致mTORC1抑制和AMPK激活。一方面AMPK使泛素连接酶复合物BRCA1/BARD1减少,增加LXRα,并上调包括ABCA1和ABCG5/G8在内的胆固醇转运蛋白的表达,胆固醇外排增多;另一方面AMPK抑制SREBP通路,抑制脂肪生成。
(图3右)当ASGR1缺失或被抑制时,糖蛋白内吞降解减少,溶酶体内的氨基酸水平降低,导致mTORC1抑制和AMPK激活。一方面AMPK使泛素连接酶复合物BRCA1/BARD1减少,增加LXRα,并上调包括ABCA1和ABCG5/G8在内的胆固醇转运蛋白的表达,胆固醇外排增多;另一方面AMPK抑制SREBP通路,抑制脂肪生成。

图3:ASGR1调控机制的工作模型
该项研究不仅揭示了ASGR1影响胆固醇代谢的机制,还进一步探索了ASGR1在治疗胆固醇代谢异常引起的疾病方面的应用。研究人员通过多轮筛选,开发了一款效果非常好的单克隆抗ASGR1中和抗体4B9。4B9-IgG能在生理条件下抑制ASGR1的功能,能够有效降低血脂和肝脂,促进胆固醇外排,并且该抗体与他汀类药物、依折麦布联用时具有协同降脂作用,为ASGR1作为新的降脂靶点提供了依据。
综上,本研究提供了一种独特的降胆固醇方式,抑制ASGR1会增加胆汁和粪便中的胆固醇外排,ASGR1的功能丧失变体与降低非HDL胆固醇和减少复发性心血管疾病相关,这提示抑制ASGR1是治疗心血管疾病安全有效的方法。
胆固醇相关机制研究及药物开发需要动物模型支撑,集萃药康基于自主搭建的基因编辑平台构建出多种高胆固醇血症研究模型,助力基础科研和药物研发。
集萃药康高血脂模型活体列表

参考文献
- Luo, J., Yang, H., and Song, B.L. (2020). Mechanisms and regulation of cholesterol homeostasis. Nat Rev Mol Cell Biol. 21, 225-245.
- Ma, L. Y. et al. China cardiovascular diseases report 2018: an updated summary. J. Geriatr. Cardiol. 17, 1–8 (2020).
- Luo, J, Wang, J.K., Song, B.L. (2022). Lowering low-density lipoprotein cholesterol: from mechanisms to therapies. Life Metabolism. https://doi.org/10.1093/lifemeta/loac004.
- Nioi, P. et al. Variant ASGR1 associated with a reduced risk of coronary artery disease. N. Engl. J. Med. 374, 2131–2141 (2016).
- Ashwell, G. & Harford, J. Carbohydrate-specific receptors of the liver. Annu. Rev. Biochem. 51, 531–554 (1982).
- Kim, K.H., Yoon, J.M., Choi, A.H., Kim, W.S., Lee, G.Y., and Kim, J.B. (2009). Liver X receptor ligands suppress ubiquitination and degradation of LXRalpha by displacing BARD1/BRCA1. Mol Endocrinol. 23, 466-474.
- González, A., Hall, M. N., Lin, S. C. & Hardie, D. G. AMPK and TOR: the yin and yang of cellular nutrient sensing and growth control. Cell Metab. 31, 472–492 (2020).
- Ling, N. X. Y. et al. mTORC1 directly inhibits AMPK to promote cell proliferation under nutrient stress. Nat. Metab. 2, 41–49 (2020).






